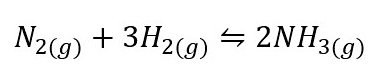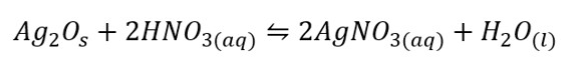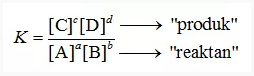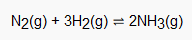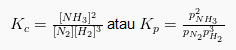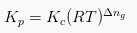Kesetimbangan Kimia – Sistem terhadap kesetimbangan yakni akan cenderung untuk mempertahankan dalam keseimbangannya sambil memulihkan keseimbangan ketika pengaruh eksternal sistem berubah dengan cepat.
Konsep dalam keseimbangan kimia yakni telah dikembangkan yakni setelah Berthollet (1803), beliau telah menemukan bahwa adanya sebuah reaksi kimia dapat berbalik. Dalam setiap campuran reaksi tersebut, dalam kesetimbangan, laju reaksi mundur dan reaksi maju ialah sama.
Dalam pembahasan kali ini, kami akan menjelaskan secara lengkap dan jelas yakni mengenai Kesetimbangan Kimia. Untuk ulasan selengkapnya, yuukk… Simak sebagai berikut.
Apa itu Kesetimbangan Kimia ?
Pengertian Kesetimbangan Kimia adalah reaksi substitusi pada level reaktan, dan produknya sama dan konsentrasi kedua konstan. Keseimbangan dalam sebuah rumus kimia hanya terjadi dalam reaksi di mana laju pembentukan reaktan sesuai dengan laju pembentukan produk.
Keseimbangan kimia bersifat dinamis dan karenanya sering disebut sebagai keseimbangan. Keseimbangan dinamis adalah reaksi bolak-balik ketika konsentrasi konstan tetapi reaksi kontinu. Persamaan dinamis tidak muncul secara makroskopik, namun mikroskopis (masalah partikel).
Keseimbangan kimia hanya ada dalam reaksi di mana laju reaksi sekali lagi sama dengan laju pembentukan produk. Dalam sebuah reaksi-reaksi ini cenderung terjadi secara mikroskopis, dari itu menjadi seimbang.
Kesetimbangan Kimia Bersifat Dinamis
Reaksi kesetimbangan dinamis berarti bahwa reaksi berlangsung kontinu dalam dua arah yang berbeda dan dengan reaksi yang sama. Contoh dalam adanya suatu keseimbangan harian yang dinamis yakni bisa diilustrasikan dalam proses penguapan air. Ketika air dipanaskan dalam wadah yang tertutup, dengan air menjadi uap air.
Namun belum, uap air yang naik di atasnya jenuh jika ingin jatuh kembali ke embun. Jika dibiarkan berlanjut, laju penguapan air sesuai dengan laju di mana dalam suatu uap air melakukan ke dalam air. Pada titik ini tercapai keseimbangan ketika tidak ada permukaan air dalam wadah yang tertutup.
Karena dalam adanya suatu keseimbangan yang dinamis, reaksi dengan sebuah keadaan keseimbangan yakni dapat terganggu oleh faktor-faktor tertentu yang menyebabkan keseimbangan terjadi.
Pergeseran Kesetimbangan
Sistem terhadap kesetimbangan yakni akan cenderung untuk mempertahankan dalam keseimbangannya sambil memulihkan keseimbangan ketika pengaruh eksternal sistem berubah dengan cepat.
Kimiawan Perancis Henri Le Chatelier mengatakan bahwa jika reaksi kesetimbangan kimia menerima perubahan kondisi (menerima efek luar), reaksi akan menghasilkan keseimbangan baru dengan perubahan tertentu untuk melawan perubahan yang diterima (sebagai respons terhadap perubahan) yang diterima secara tidak sengaja). Ini disebut sebagai prinsip Le Chatelier.
Jenis-Jenis Keseimbangan
Adapun berbagai jenis-jenis dalam keseimbangan ini, diantaranya ialah sebagai berikut:
- Kesetimbangan Statis
Kesetaraan atau keseimbangan yakni secara statis berarti bahwa semua gaya yang bekerja pada suatu objek praktis tidak dapat dihasilkan.
- Keseimbangan Dinamis
Yakni telah tercapai ketika semua gaya pada suatu objek seimbang, namun dalam suatu objek itu sendiri bergerak.
Keseimbangan kimia tersebut yakni jatuh ke dalam kategori dinamis karena terdiri dari reaksi maju ketika reaktan menghasilkan produk dan reaksi balik ketika produk menghasilkan reaktan. Selain itu, dalam proporsi relatif masing-masing bahan kimia juga tidak berubah.
Seperti keseimbangan kimia, keseimbangan secara dinamis yakni bisa terjadi dalam sistem tertutup pada suhu konstan. Ada dua kelompok kesetimbangan berdasarkan keadaan fisik reaktan dan produk, yakni kesetimbangan heterogen dan kesetimbangan homogen.
Kesetimbangan Homogen
Dalam adanya keseimbangan terhadap homogen yang nantinya akan terjadi ketika semua reaktan dan produk berada pada tahap yang sama. Contohnya bisa dilihat pada reaksi berikut:
Keseimbangan Heterogen
Sebaliknya, jika dalam keseimbangan heterogen terjadi dengan ketika reaktan dan produk tidak dalam tahap yang sama. Contohnya bisa dilihat pada reaksi berikut:
Persamaan Reaksi Keseimbangan
Sebagai rumus reaksi yang dapat dibalik, keseimbangan pada suhu yang ditentukan adalah sebagai berikut:
Kesetimbangan konstan yakni dapat dinyatakan sebagai rasio jumlah konsentrasi reaktor dibagi dengan peningkatan konsentrasi produk, konsentrasi setiap zat dalam formula reaksi yang sama ditingkatkan menjadi koefisien stoikiometrik.
Ketika menghitung konstanta kesetimbangan untuk reaksi homogen (semua zat dalam reaksi fase yang sama), konsentrasi zat dalam sistem larutan dapat dinyatakan oleh konsentrasi molar, hingga K juga yakni bisa dinyatakan sebagai Kc.
Sebagai reaksi homogen dalam fase gas, konsentrasi zat dalam keadaan gas yang bisa dinyatakan sebagai tekanan parsial zat, dan simbol konstanta kesetimbangan menjadi Kp. Misalnya, hukum kesetimbangan kimia dapat dinyatakan dalam dua bentuk untuk reaksi berikut:
atau :
Hubungan Kp dan Kc ialah:
Keterangan:
- R = Gas konstan universal
- Δng = Volume molar produk gas – volume molar gas reaktan
- T = Suhu
Perhitungan konsistensi kesetimbangan adalah reaksi heterogen (reaksi dalam lebih dari satu fase) yang terdiri dari zat-zat dalam bentuk cairan murni atau padatan murni, tidak ikut dan mengabaikan terhadap suatu konsentrasi cairan dan padatan.
Baca Juga :
Demikianlah pembahasan yang telah kami sampaikan secara lengkap dan jelas yakni mengenai Kesetimbangan Kimia. Semoga ulasan ini, dapat berguna dan bermanfaat bagi Anda semuanya.